血红蛋白
Hb主要存在于红细胞,其主要功能是作为氧气的运输者,为整个机体运输氧气。
除了红细胞以外,机体内还有一些细胞可以表达少量的Hb,例如黑质内的A9多巴胺能神经元、巨噬细胞、肺泡细胞和肾的血管系膜细胞等。这些组织表达HB的功能显然与运输氧气无关,而是作为一种抗氧化剂以及调节细胞内铁的代谢。
Hb由4个亚基组成,因而有四级结构。每一个亚基称为珠蛋白,单个亚基的一级结构与Mb差别较大,只有27个位置的氨基酸残基与Mb相同,但二级和三级结构却与Mb十分相似。

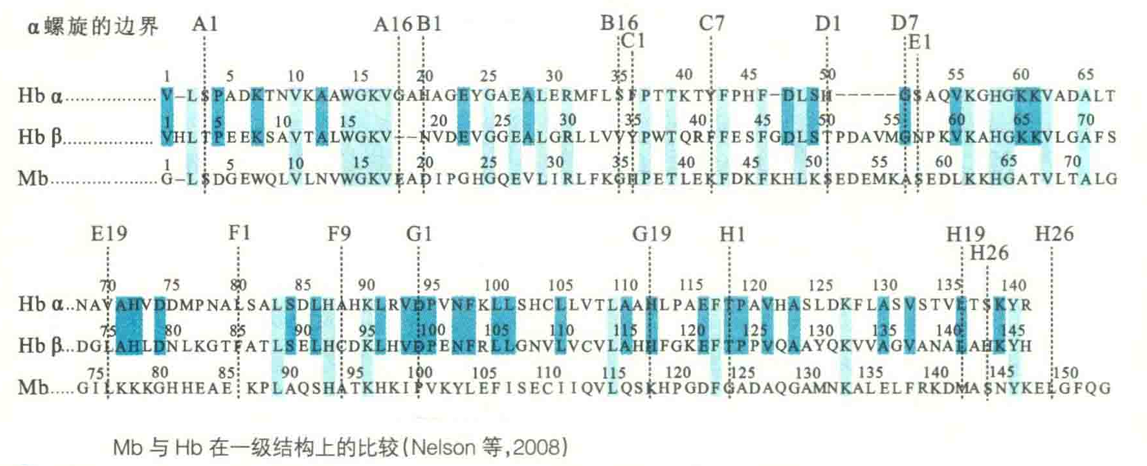
与Mb相比,Hb之所以更适合充当氧气的运输者,主要的原因是因为它具有四级结构。而具有四级结构的特征使得它在结合氧气的时候,具有3个重要的效应:正协同效应、波尔效应和别构效应。这3个效应都有利于Hb更适合充当氧气运输者的角色。
正协同效应
Hb氧合曲线为S形曲线。这意味着,只有在pO2很高的情况下(在肺部或鳃),Hb才能更好地结合氧气,而pO2一旦降低(在外周血管中),它就开始释放O2,而此时的Mb却没有反应。就结合O2的亲和力而言,4价的Hb还不如1价的Mb。
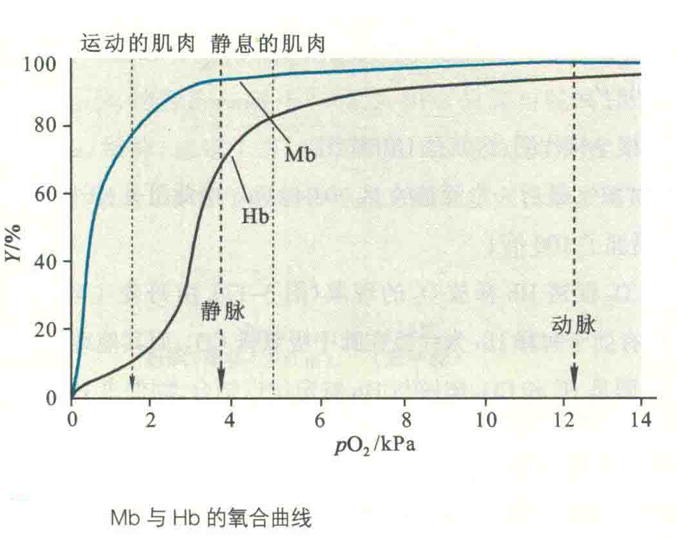
Hb的氧合曲线之所以呈现为S,是因为Hb与O2的结合具有正协同效应。
Hb的正协同效应是指Hb分子有一个亚基结合O2后,其构象会发生变化,使得其他亚基对O2的亲和力突然增强。
理论解释
协同效应可使用齐变或序变模型来解释。两种模型都假定血红蛋白存在两种构象,即紧张态(T态)和松弛态(R态)。
在没有结合氧气时,Hb的4条链之间结合紧密,此时Hb主要以T态存在。这种紧密结合是由盐键以及结合在2条β链之间缝隙中的2,3-二磷酸甘油酸(2,3-BPG)造成的,它们屏蔽了分子表面疏水的空穴,使得Hb结合O2的能力降低(单独的α链和β链结合氧气的能力与Mb相同)。
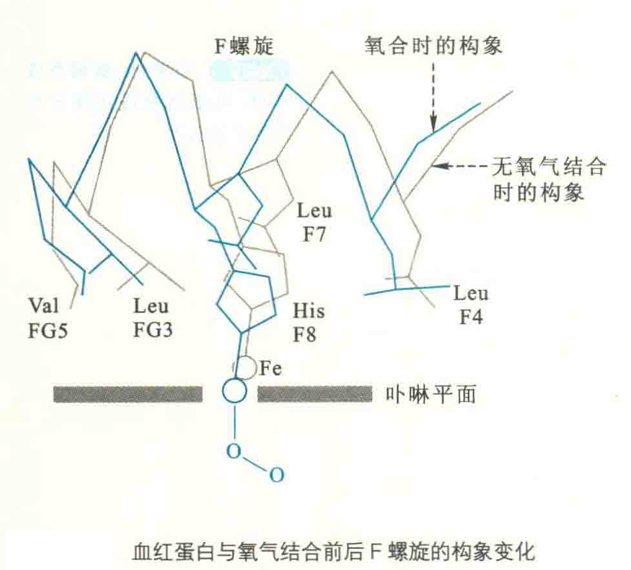
在脱氧状态下,Hb上的Fe2+由于邻近His残基和毗咯环N原子之间的空间位阻,而略偏离血红素平面(0.04 nm)。然而,一旦氧合,Fe2+就移向卟啉环,致使O2能更好地结合。
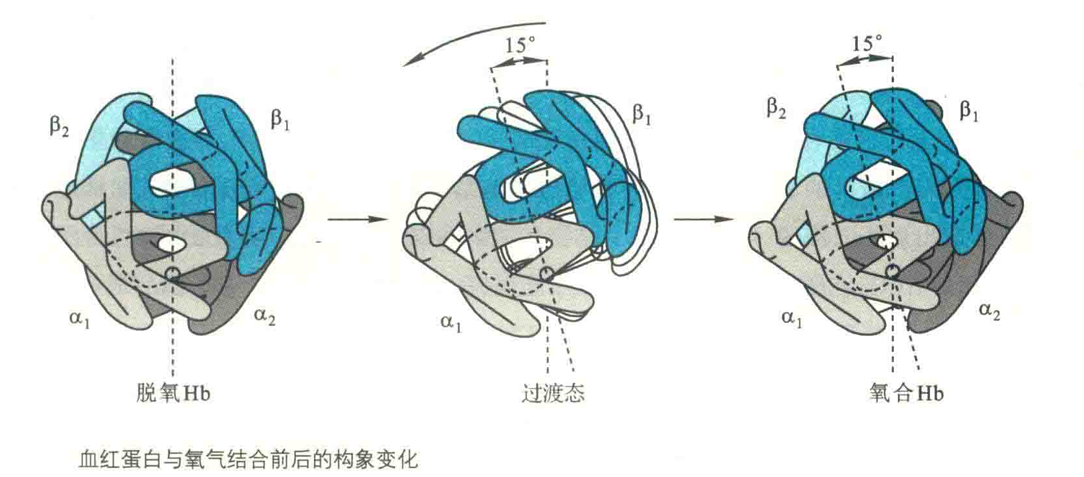
Fe2+的移位将近端HiS拉向血红素,近端His的移动又带动F螺旋也随之移动,而F螺旋的移动势必影响到它与相邻亚基的C螺旋之间的相互作用,最终导致相邻亚基的构象发生改变。
于是,相邻肽链之间的盐键遭到破坏,Hb的四级结构也随之改变。这时2个二聚体(αβ)之间发生滑移,移动15°,将BPG挤出。
随后,四级结构发生进一步的变化,每条肽链表面疏水的空穴都暴露在外,这时的Hb主要以R态存在,于是它结合O2的能力变强了。
量化评估
为了对Hb的正协同效应进行量化评估,需要在Hb的O2分数饱和度方程中引入所谓的Hill系数。于是:
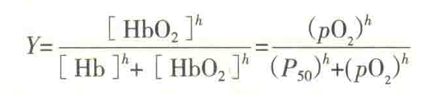
如果h=1,上面的方程实际上就是Mb的氧合方程,因此无协同效应;如果h>1,就有正协同效应;如果h<1,就有负协同效应。上面方程转化为:Y/(1-Y)=(pO2/P50)^4
经过线性处理后变成:lg Y/(1-Y) = hlg pO2 -hlg P30
以lg [Y/(1-Y)]为纵坐标,lg pO2为横坐标作图,即为Hill作图。
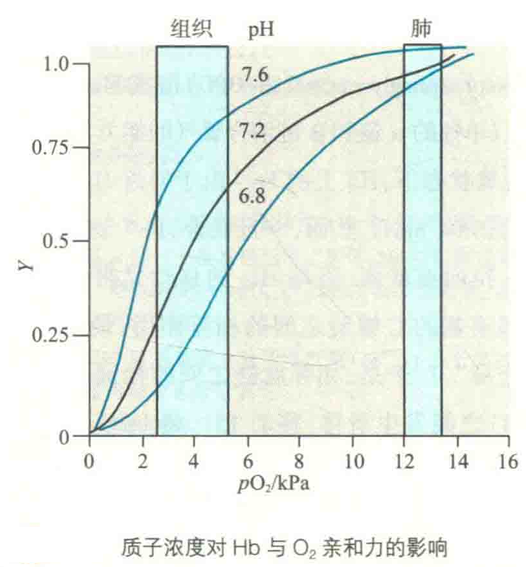
根据测定,第一个亚基与O2结合的P50=4 kPa,最后一个亚基的P50=0.04 kPa。由此可见,正协同效应导致Hb最后一个亚基对O2的亲和力增加了100倍。
波尔效应
波尔效应是指H+和CO2促进Hb释放O2的现象。波尔效应也有助于解释Hb为什么在肺中吸氧排CO2而其他地方(肌肉组织)吸CO2 排氧。
产生波尔效应的原因是H+和CO2能够与Hb特定位点结合,而促进Hb从R态转变为T态。
与H+引发的波尔效应相关的基团有:α 亚基的N端氨基、α亚基的HiS122咪唑基、β亚基的Hisl46咪唑基。这3个基团在Hb处于T态的时候都是高度质子化的,而当O2与Hb结合以后,质子即发生解离。
如果溶液中的pH降低,将有利于这3个基团处于质子化状态,从而稳定T 态,抑制氧气的结合。
用反应式来表示,即为:Hb+4O2→HB(O2)4 + nH+。显然PH下降,即H+浓度 升高,会使反应平衡向左移动,这时有利于Hb释放结合的Ο2。
产生途径
CO2可通过两种途径产生波尔效应。这两种途径不仅有助于CO2进入肺部呼出体外,而且也能够促进O2的释放。
第一种是在碳酸酐酶的催化下,红细胞内的CO2发生反应:CO2+H2O → H2CO3 → H+ + HCO3-。此反应释放出质子而产生波尔效应,同时产生的HC0;进入血浆,随循环到达肺部;
第二种是CO2与Hb的N端氨基可逆的反应:CO2 + Hb-NH2-H++Hb-NHCOo-,形成氨基甲酸血红蛋白,也释放出质子,这对波尔效应也有贡献。
但更重要的是,此反应可导致在α和β亚基之间形成新的盐键,而有助于Hb处于T态,使其更容易将结合的O2释放出来。
CO2主要通过这两种途径进入肺,分别占85%和15%,只有5%的CO2以溶解的形式随循环进入肺。
在肺部,较高的氧分压使得Hb能够有效地结合O2,而正协同效应使得Hb从T态变成R态,并释放出质子。
同时,与Hb氨基端结合的CO2也被释放出来。释放出的H+与随血液循环到达肺部的HCO3-在碳酸酢酶的催化下,发生逆反应,产生CO2和H2O,CO2随后通过呼气排出体外。
别构效应
别构效应是指除O2以外的各种配体在血红素铁以外的位点与Hb结合,导致Hb的构象发生变化,进而影响到Hb氧合能力的现象。哺乳动物体内能与Hb结合的配体有Η+、CO2、2,3-BPG和NO,它们统称为别构效应物。H+和CO2产生的效应就是波尔效应。2,3-BPG产生的效应也是增强Hb在外周组织释放氧气的能力。
2,3-BPG作为糖酵解的副产物广泛存在于红细胞,其浓度与Hb不相上下,约为5 mmol/L。
2,3-BPG只能与脱氧Hb内位于两条β亚基之间带正电荷的空穴(1.1 nm)结合,稳定T态,显著降低Hb与O2的亲和力,促进Hb在组织中释放O2。
氧合Hb位于两条β亚基之间的空穴已经显著变小,只有0.5nm,容纳不下0.9 nm大小的BPG了。
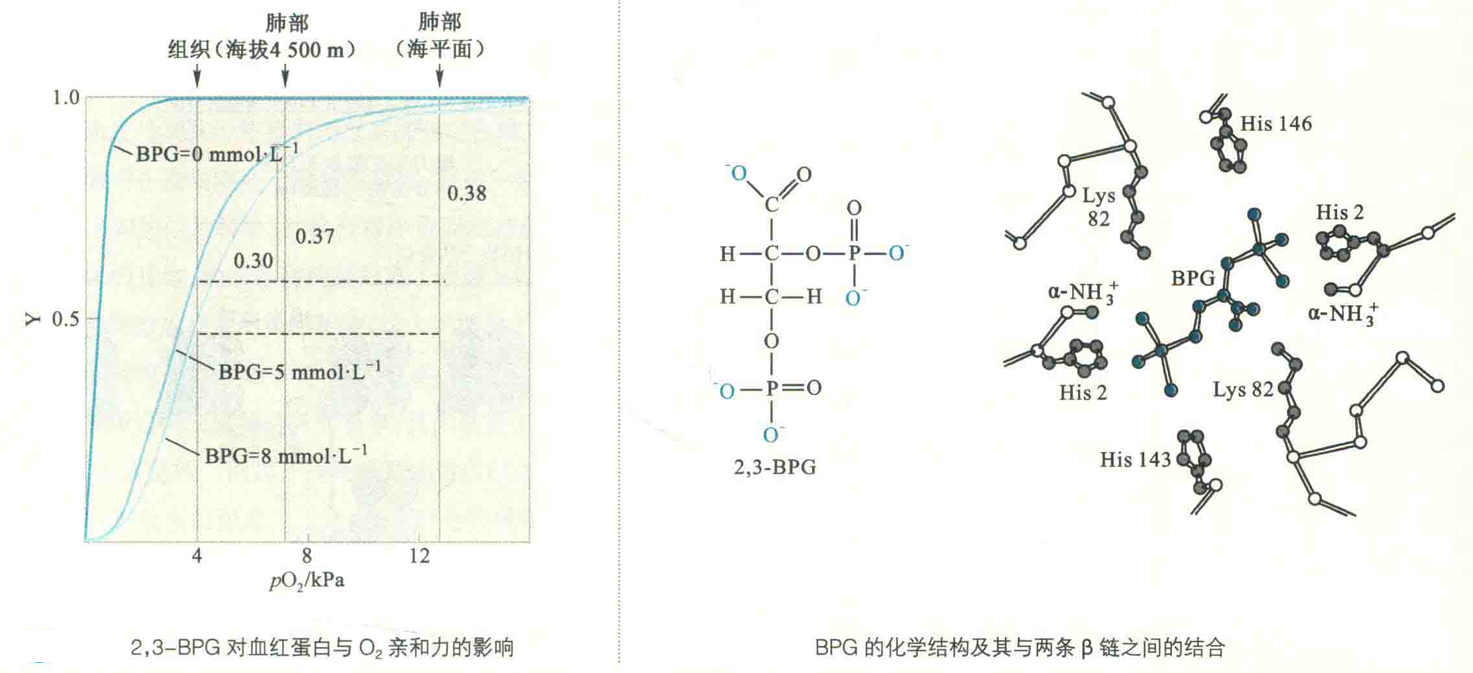
生活在高海拔地区可诱导红细胞内的BPG水平的上升,这显然是生物对缺氧环境的一种适应。在高海拔地区,大气中的氧气较为稀薄,将氧气有效地释放到外周组织变得困难。
为了适应这种环境,体内红细胞的数目会增加,同时机体开始加速合成2,3-BPG。大概24h以后,体内的2,3-BPG水平便开始持续上升。除此以外,贫血、肺功能衰弱和长期吸烟也可导致体内BPG水平上升。
胎儿血红蛋白HbF与O2的亲和力明显高于成人的HbA,这显然有利于胎儿通过胎盘(氧分压大大低于肺)从母亲那里获取Ο2。HbF与O2亲和力之所以高于HbA,是因为与α亚基结合的γ亚基不能结合BPG。
不是所有的动物都使用2,3-BPG来降低Hb与O2的亲和力。例如,鱼类使用ATP和GTP来结合Hb,以稳定它的T态构象,从而降低它与O2的亲和力。但在缺氧的条件下,鱼类红细胞内的ATP和GTP水平下降,这又提高了Hb与O2的亲和力。
至于NO对Hb结构与功能的影响,有研究表明:Hb在氧合状态下,NO可与其特定位置的Cys残基侧链上的疏基结合,形成S-亚硝基硫醇。而一旦Hb释放氧气,NO就立刻解离到外周组织,通过扩张血管,有助于氧气在局部的运输。