肌红蛋白
Mb只存在于肌细胞中,心肌含量特别丰富。
其功能是作为氧气的贮存者,专门为动物的肌肉组织贮备氧气,因为肌肉组织对氧气的需求比较大,特别是在做激烈运动的时候。水生哺乳动物(如鲸鱼)体内的Mb含量尤其丰富,因此它们可以在水下长时间憋气。
Hb的一级结构
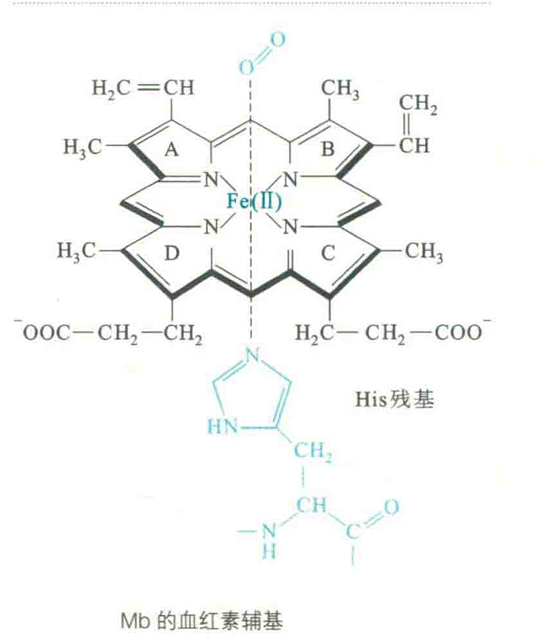
Mh的一级结构特征包括:由一条肽链组成,含有153个氨基酸残基;紧密结合1个血红素辅基。血红素由原卟啉和Fe2+组成。
Mb的二级结构
Mb的二级结构特征包括:共有8段α螺旋,它们约占全部序列的75%,按照N端到C端的次序,被依次编号为A、B、C、D、E、F、G、Η。螺旋之间是短的β转角或小环(CD表示C、D螺旋之间转角或环,以此类推)。有4个螺旋终止于Pro残基。
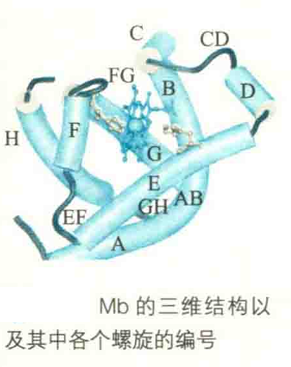
Mb是第一个获得完整三维结构的蛋白质。1959年,John Kendrew和Max Perutz使用X射线晶体衍射的方法,成功获得抹香鲸肌红蛋白的三维结构。1962年,Kendrew和Perutz因此而荣获诺贝尔化学奖。
Mb整条肽链与血红蛋白的每一条肽链一样,折叠成紧密的球状结构,疏水侧链大都在分子内部,极性、带电荷的侧链则暴露在分子表面,因此水溶性好。
其分子表面有一个深的疏水口袋,口袋的侧面由E螺旋和F螺旋组成,底部由G螺旋和H螺旋组成。血红素“藏”在袋中,与周围氨基酸残基形成次级键,而Fe"与F螺旋8号位的HiS残基(HisF8)形成配位键。
该口袋既可让O2进入与Fe2+结合,又可防止Fe2+被氧化成Fe3+,但阻止H2O的进入。
Fe2+一共可以形成6个配位键,在结合氧气之前,它已形成了5个配位键——4个与原卟啉吡咯环上的N原子,1个与HisF8的咪唑基。HisF8被称为近端组氨酸。
显然第6个配位键是专门为O2预备的,O2可以通过这个配位键可逆地与Fe2+结合。
CO中毒
但如果Fe2+被氧化成Fe",水分子就会立刻占据第6个配位键,而导致氧气无法结合。
CO与O2差不多大,因此也能与血红素结合。CO的毒性主要是因为它与血红素的亲和力更强,从而阻止了与血红素的结合。
高铁血红蛋白症
游离的血红素也能够与氧气结合,但它们在溶液中很容易相互靠近,在有氧的情况下,所有的铁都会被氧化成高价态。而“高铁”是不能结合氧气的,因此生物没有选择用游离的血红素分子来运输或者贮存氧气。
如果血红素结合在Mb或者Hb的疏水口袋之中,血红素分子之间等于被安全隔离起来,其中的铁也就难以氧化了。因此,Mb的作用实际上是用疏水口袋保护血红素的二价铁,防止它被氧化。
然而,尽管Mb和Hb本身已为上面的Fe2+提供了很好的保护,但是细胞内的各种氧化剂仍有可能对其进行氧化,从而导致体内出现少量无功能的高铁血红蛋白和高铁肌红蛋白。
防御机制
幸好正常人的体内还有一种保护机制,这种机制主要依赖细胞色素b5还原酶。该酶也被称为NADH-高铁血红蛋白还原酶,能够利用细胞内的还原性辅酶I(NADH/H)将被氧化的铁还原成低价态。此外,有一种次要的NADPH-高铁血红蛋白还原酶也具有类似的功能。
发病机制
如果一个人缺乏有功能的细胞色素b5还原酶,那体内的met-Hb水平就可能异常的高,从而得高铁血红蛋白症。
高铁血红蛋白症患者由于大量met-Hb的存在,而降低了红细胞的携氧能力,令他们的血液颜色比正常人更深,皮肤的颜色也因此可能呈现为罕见的蓝色。
远端组氨酸
将血红素放到Mh和Hb上还有一个好处,就是降低血红素与CO的亲和力。根据测定,游离血红素与CO的亲和力是与O2亲和力的25000倍!而Mb和Hb分子上的血红素辅基与CO的亲和力仅是与O2亲和力的200倍。
Mb和Hb分子上的血红素辅基对CO亲和力的急剧下降与E螺旋7号位His残基(HisE7)有关。HisE7位于血红素平面的另一侧,与近端组氨酸(HisF8)隔环相望,因此也称为远端组氨酸。
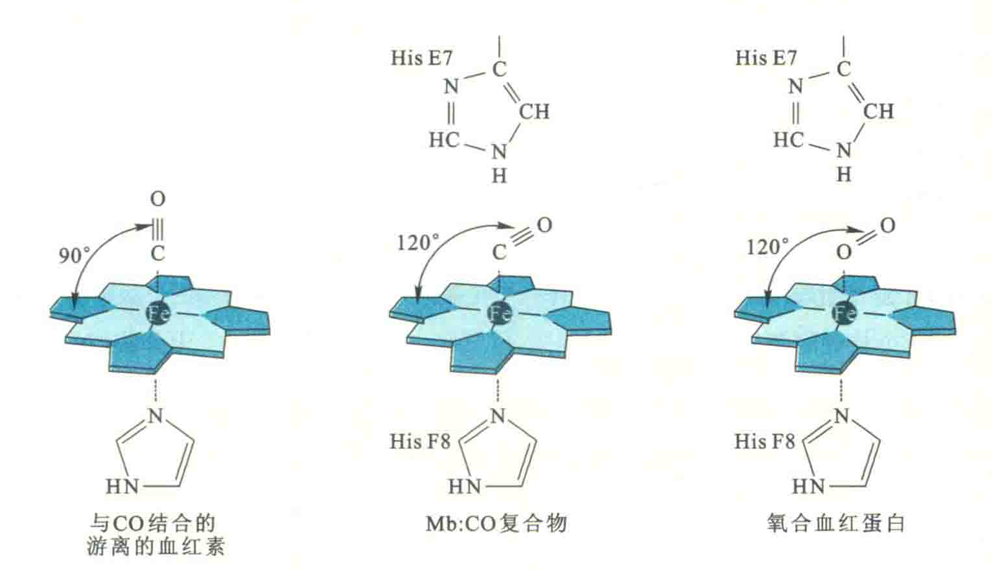
远端组氨酸和近端组氨酸一样,对珠蛋白家族的所有成员来说都是不可缺少的。
远端组氨酸有两个重要的功能:
一是保护血红素的二价铁,阻止细胞内任何可能的氧化剂对铁的氧化;
二是为CO与血红素的结合制造障碍。因为对于CO而言,它与血红素铁结合的“舒适”角度是垂直于血红素平面,即90°,而HisE7的出现使得CO只能与120°的角度结合,因此CO与血红素结合的亲和力就下降了。而对于O2来说,它与血红素铁结合的“舒适”角度就是120。,故有无HisE7对血红素结合O2没有影响。
Mb氧合曲线
Mb结合O2的特征可以用氧合曲线来描述,为双曲线的一支。
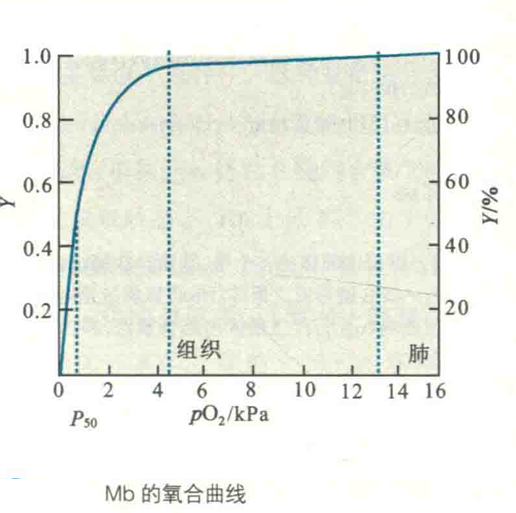

从图中可以看出,Mb倾向于结合氧气而不愿意放出氧气,因此它的功能是贮存氧气,只有在pO2极低的时候,如肌肉因剧烈运动而缺氧,它才释放出氧气。
Mb在肌肉组织中的重要生理功能似乎表明它是动物不可缺少的蛋白质。然而,有人使用基因敲除技术,培育出了缺失Mb的小鼠,结果发现,这些小鼠不仅能生存,还能正常地运动和生育,对缺氧也有正常的通气反应。
尽管这些小鼠的心肌和比目鱼肌没有正常肌肉的颜色,但功能仍显示正常。
缺失Mb的小鼠能够正常地生存,可能是因为机体为此做出各种代偿性反应,如Hb浓度、血流量和毛细血管密度都有所提高。