α角蛋白
α角蛋白因二级结构主要是α螺旋而得名。它广泛存在于动物的毛发、角、鸟喙和爪子中,可分为不同的亚型,如I型和Π型。
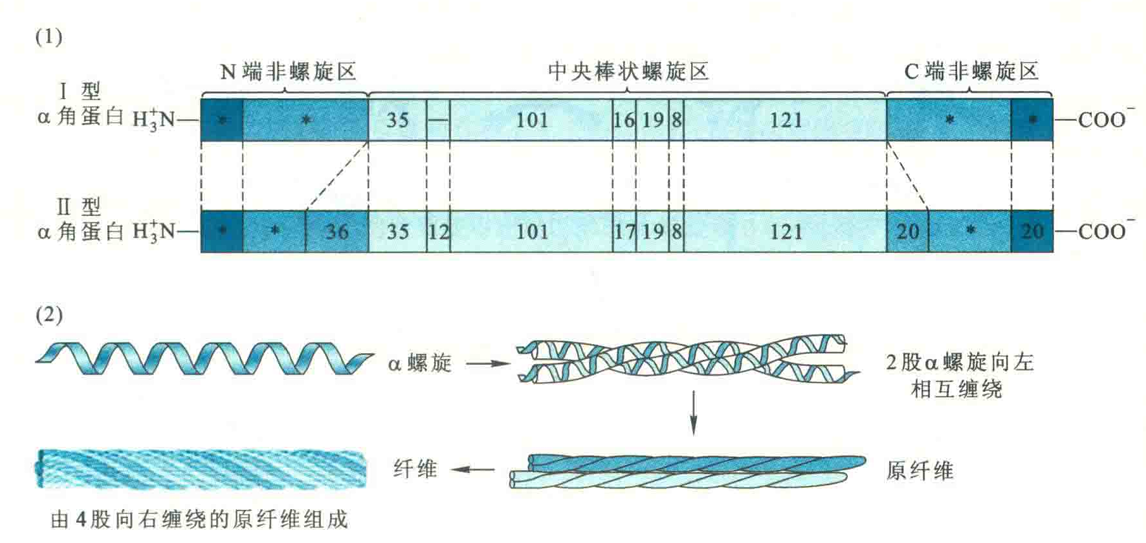
其一级结构由311~314个氨基酸残基组成。每一个α角蛋白分子在肽链的中央形成典型的α螺旋,而两端为非螺旋区。
螺旋区由七肽重复序列(-a-b-c-d-e-f-g-)组成,a位和d位刚好为疏水氨基酸。
这样的分布让两个α角蛋白分子可通过a位和d位的疏水R基团结合,并相互缠绕形成一种双股的左手超螺旋,即卷曲螺旋。
卷曲螺旋大大地提高了α螺旋的稳定性。此外,在链间还有二硫键,这种共价交联可进一步提高α角蛋白的强度。
指甲的强度比毛发高是因为含有更多的Cys残基,能形成更多的二硫键。
α角蛋白分子还可以在双股的卷曲螺旋的基础上,先形成原纤维,然后再由原纤维组装成纤维。
TIP
在美发过程中,无论是卷发还是直发,原理都一样:先用硫基类化合物(如巯基乙酸铵或半胱氨酸)破坏二硫键(大约45%的二硫键被切断),使之被还原成游离的巯基,易于变形;再用发夹和发卷将头发塑成一定的形状(卷发让头发成为波状,直发则将头发拉直);最后用氧化剂重建二硫键,使发型固定下来。
在机体内,除了α角蛋白分子之间可以形成卷曲螺旋这样稳定的超螺旋结构以外,还有其他的一些蛋白质,它们都属于卷曲螺旋蛋白超家族的一员。
例如,人体属于这一超家族的蛋白质约有60种,它们包括构成细胞骨架的中间纤维以及肌球蛋白(myosin)和原肌球蛋白等。