β折叠
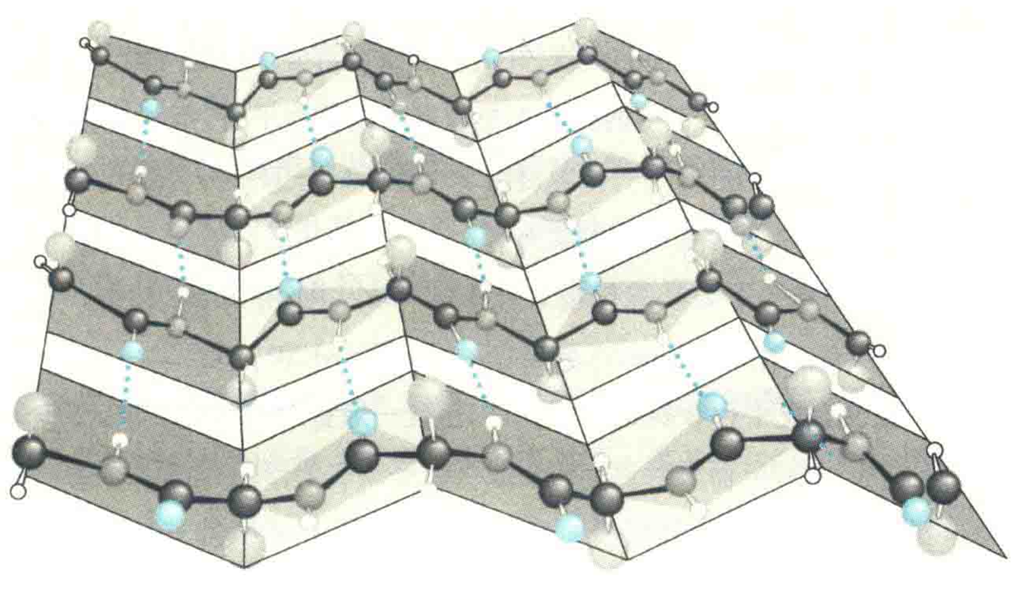
β折叠又称为β折叠片层,与α螺旋相比,β折叠是肽链的一种更加伸展的结构,主链呈扇面状展开。
主要特征
- 至少由两条肽段组成,每一条肽段几乎完全伸展,肽平面之间呈锯齿状。
- 每一条肽段称为β股,相邻β股呈现平行排列,主链之间通过氢键相连。
- R基团垂直于相邻两个肽平面的交线,并交替分布在折叠片层的两侧。
- 肽段的走向有正平行和反平行两种。正平行经常简称为平行,指相邻β股的N端位于同侧,反平行正好相反。在反平行折叠中,同一个氢键的3个原子(N-H-O)几乎位于同一直线上,因此反平行折叠更加稳定,其存在的概率就更大。
- 反平行β折叠的每一个氨基酸残基上升0.347 nm,二面角(Φ,ψ)约为(-135°,140°),平行β折叠的每一个氨基酸残基上升0.325 nm,二面角角为(-120°,105°)。
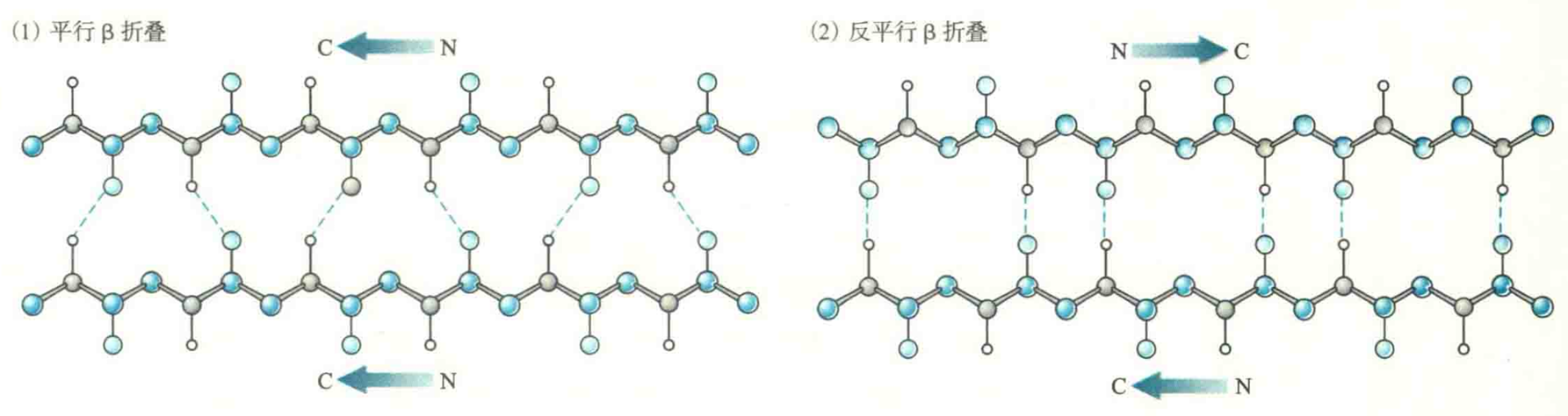
因为平行β折叠没有反平行β折叠稳定,所以前者一般含有较多的β股,很少低于5个,并且β股总是被包埋在蛋白质的内部,而后者含有的β股可以低到2个,其一面经常暴露在水相中。
不管是哪一类β折叠,在两边的β股上总会有一些羰基O和氨基H没有参与形成β折叠内部的氢键,因此要通过其他方式来满足它们形成氢键的“欲望”,这些方式包括:
①如果β股正好暴露在水相中,就与水分子形成氢键;
②如果β股在蛋白质的内部,可以与其他二级结构(如α螺旋)上的亲水氨基酸残基的侧链形成氢键;
③如果β股在蛋白质的表面,就与其他有相同问题的蛋白质分子的表面β股形成β折叠;
④构成β折叠的所有β股在空间上发生一定的扭曲,以便让第一股和最后一股靠近,即首尾相连而形成氢键,以致这些β股聚集在一起,形成一种伸展的右手扭曲结构。这样的结构实际上是一种结构模体(见后),存在于多种蛋白质分子的核心。
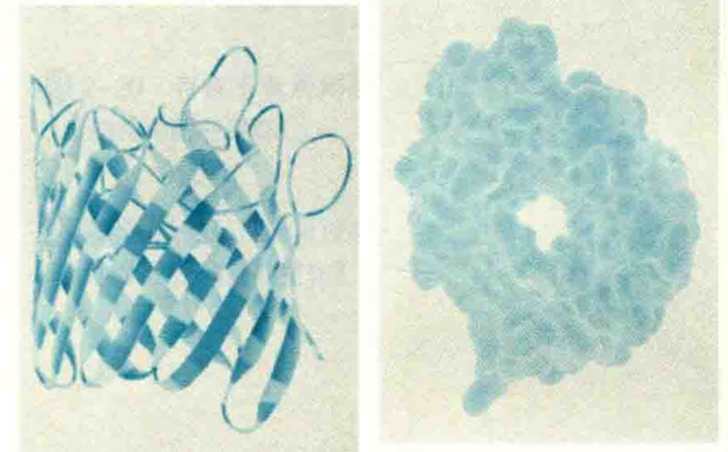
如果β股交替出现疏水残基和亲水残基,那么可以形成两亲β折叠。这样的结构常见于孔蛋白。孔蛋白是一种膜蛋白,由两亲β折叠构成β桶结构。在β桶结构中,非极性残基的侧链伸向膜脂的疏水区,极性残基在内部形成亲水通道,允许极性分子通过膜。
有时,两个蛋白质分子在特定的条件下,可以各提供一个β股形成β折叠,从而导致两者瞬间结合,形成临时的复合物(如真核细胞内的Raf蛋白和Rap蛋白),这种情况经常出现在细胞的信号转导过程中。
相比于α螺旋,参与形成β折叠的β股在空间上处于更加伸展的状态,因而那些在α螺旋中容易产生空间位阻的氨基酸残基能在β折叠中找到合适的位置,即侧链基团庞大的氨基酸残基更倾向于形成β折叠。
那些在β碳上无分支的氨基酸残基也适合存在于β股上,但大的疏水侧链更容易紧密地结合在一起,故它们出现在β折叠中的频率更高。这些氨基酸残基有Val、Ile、Phe、Tyr、Trp、Thr。Pro的刚性环结构限制了它的小值(-85°~-35°),而β折叠的φ值在-119°左右,所以Pro从来不会出现在β折叠中。